
Demostren una connexió entre el metabolisme de la glucosa i els tumors colorectals
Un equip internacional de científics, encapçalat per l’investigador espanyol Carlos Sebastián Muñoz, director del Laboratori de Dinàmica Metabòlica del Càncer de la UB, ubicat al Parc Científic de Barcelona, ha descobert que a l’intestí hi ha una població específica de cèl·lules, amb un elevat metabolisme glucolític, que serien responsables de la iniciació i disseminació tumoral. La troballa, publicada a la revista Nature Communications, demostra que el bloqueig de la reprogramació metabòlica d’aquestes cèl·lules inhibeix la seva capacitat per formar tumors intestinals, la qual cosa obre una via al desenvolupament d’una innovadora estratègia terapèutica (first-in-class) contra aquest tipus de càncer.
L’estudi, codirigit pel Dr. Carlos Sebastián, investigador Beatriz Galindo, i el Prof. Raul Mostoslavsky del Massachusetts General Hospital Cancer Center (associat a la Harvard Medical School), ha comptat amb la participació de prestigiosos investigadors del Candiolo Cancer Institute-FPO (Torí, Itàlia) i de diversos hospitals i departaments de la Universitat de Harvard.
El càncer colorectal és un dels càncers més freqüents a Espanya, tant en homes com en dones, amb 40.000 casos diagnosticats el 2021, segons l’Associació Espanyola Contra el Càncer (AECC). Malgrat els avanços al seu diagnòstic i tractament, la taxa de mortalitat segueix sent molt elevada, i representa la segona causa de mort per càncer.
El metabolisme de la glucosa, un factor clau en els tumors intestinals
Avui dia, és un fet constatat per la comunitat científica que les cèl·lules canceroses metabolitzen la glucosa de manera diferent a les cèl·lules normals.
“En estudis anteriors nosaltres ja vam demostrar que el metabolisme de la glucosa juga un paper clau en la iniciació de tumors intestinals en models murins de càncer colorectal. Ara, en aquest nou estudi hem descobert que en aquests tumors existeix una població de cèl·lules que es caracteritzen per tenir un elevat metabolisme de la glucosa (cèl·lules glucolítiques) i que es comporten com a cèl·lules mare, és a dir, són pluripotents i tenen la capacitat d’iniciar un tumor”, explica el Dr. Carlos Sebastián, afiliat al Departament de Biologia Cel·lular, Fisiologia i Immunologia de la Facultat de Biologia de la Universitat de Barcelona (UB) i a l’Institut de Biomedicina de la UB (IBUB).
Aquests resultats revelen que els tumors intestinals són metabòlicament heterogenis i suggereixen que existiria una jerarquia on una petita població de cèl·lules altament glucolítiques serien les responsables de la iniciació i disseminació tumoral.
“Per poder analitzar aquesta heterogeneïtat, van desenvolupar un nou sistema que, combinat amb organoides intestinals (cultius 3D que imiten la composició cel·lular de l’intestí), ens ha permès visualitzar, rastrejar i caracteritzar cèl·lules amb diferents propietats metabòliques a l’epiteli intestinal i en tumors a escala de cèl·lula senzilla. La caracterització de les cèl·lules glucolítiques ens ha portat a descobrir que posseeixen activitat de cèl·lula mare intestinal i que aquest tipus cel·lular també és present en tumors intestinals”, afirma el Dr. Sebastián.
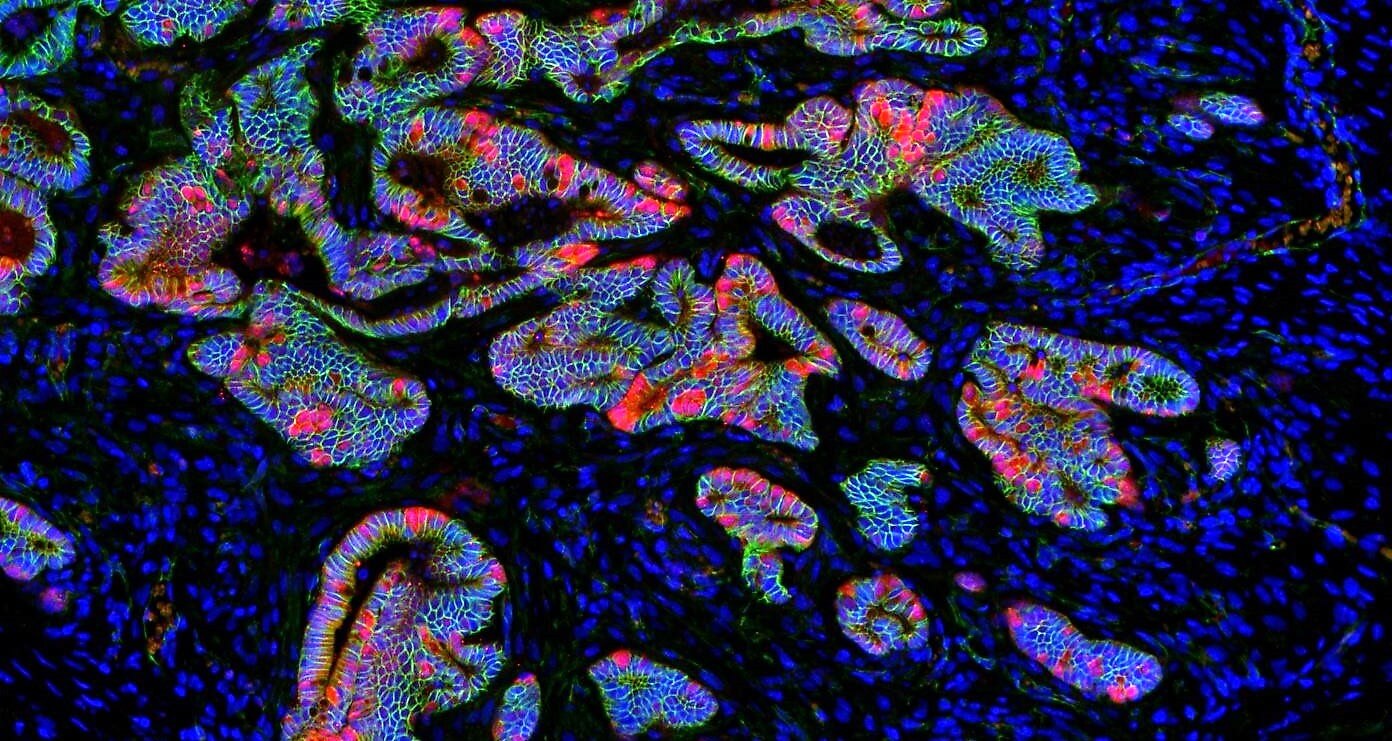
Imatge d’una immunofluorescència on s’aprecien cèl·lules amb diferents propietats metabòliques dins de l’epiteli intestinal (Autor: Dr. Carlos Sebastián).
La reprogramació metabòlica al procés tumoral
Una de les principals característiques de les cèl·lules tumorals és la capacitat de modificar el seu metabolisme (reprogramació metabòlica) per créixer, sobreviure i proliferar, la qual cosa està íntimament lligada a la progressió tumoral, la metàstasi i la resistència terapèutica.
Tradicionalment, la comunitat científica ha considerat aquestes alteracions metabòliques com a meres adaptacions encaminades a proporcionar l’energia i macromolècules necessàries per a la proliferació cel·lular. “No obstant això, els nostres estudis demostren que aquesta reprogramació metabòlica es produeix en estadis molt primerencs del procés tumoral i és una característica intrínseca associada a un determinat tipus cel·lular”, revela el científic.
A més, aquest equip d’investigadors ha descobert que el bloqueig d’aquesta reprogramació metabòlica és suficient per inhibir la capacitat de les cèl·lules glucolítiques per formar tumors intestinals. “Atès que aquestes cèl·lules iniciadores de tumors estan implicades en la progressió tumoral, en la formació de metàstasi i en la recidiva tumoral, els nostres resultats suggereixen que aquesta vulnerabilitat metabòlica podria ser emprada en el tractament del càncer colorectal”, afegeix.
Una altra de les conclusions importants del treball és la constatació que aquestes cèl·lules glucolítiques són quiescents, és a dir, no proliferen, la qual cosa proposa que aquesta reprogramació metabòlica no està associada a la producció de biomassa i proliferació cel·lular. De fet, els investigadors han observat que aquestes característiques metabòliques són necessàries per protegir aquestes cèl·lules contra l’estrès oxidatiu i mantenir el seu potencial de cèl·lula mare.
“Encara que aquests estudis han estat realitzats amb models de càncer de còlon en ratolins i, per tant, cal ser prudents a traslladar-los a la malaltia humana, els resultats podrien ser útils en un futur a l’hora de dissenyar noves teràpies més efectives per a aquest tipus de càncer. En aquest sentit, el nostre laboratori continua treballant en aquesta línia amb mostres derivades de malalts amb càncer de còlon amb la finalitat de poder aplicar les nostres troballes a aquests pacients”, destaca l’investigador.
» Referència de l’article: Sebastián C*, Ferrer C, Serra M, Choi JE, Ducano N, Mira A, Shah MS, Stopka SA, Perciaccante AJ, Isella C, Moya-Rull D, Vara-Messler M, Giordano S, Maldi E, Desay N, Capen DE, Medico E, Cetinbas M, Sadreyev RI, Brown D, Rivera MN, Sapino A, Breault DT, Agar NYR, Mostoslavsky R*. “: A non-dividing cell population with high pyruvate dehydrogenase kinase activity regulates metabolic heterogeneity and tumorigenesis in the intestine”. Nature Communications (2022). DOI: https://www.nature.com/articles/s41467-022-29085-y




