
Demuestran una conexión entre el metabolismo de la glucosa y los tumores colorrectales
Un equipo internacional de científicos, encabezado por el investigador español Carlos Sebastián Muñoz, director del Laboratorio de Dinámica Metabólica del Cáncer de la UB, ubicado en el Parque Científico de Barcelona, ha descubierto que en el intestino existe una población específica de células con un elevado metabolismo glucolítico, que serían responsables de la iniciación y diseminación tumoral. El hallazgo, publicado en la revista Nature Communications, demuestra que el bloqueo de la reprogramación metabólica de estas células inhibe su capacidad para formar tumores intestinales, lo que abre una vía para el desarrollo de una nueva estrategia terapéutica (first-in-class) más efectiva contra este tipo de cáncer.
El estudio, codirigido por el Dr. Carlos Sebastián, investigador Beatriz Galindo, y el Prof. Raul Mostoslavsky del Massachusetts General Hospital Cancer Center (asociado a la Harvard Medical School), ha contado con la participación de prestigiosos investigadores del Candiolo Cancer Institute-FPO (Turín, Italia) y de varios hospitales y departamentos de la Universidad de Harvard.
El cáncer colorrectal es uno de los cánceres más frecuentes en España, tanto en hombres como en mujeres, con 40.000 casos diagnosticados en 2021, según la Asociación Española Contra el Cáncer (AECC). A pesar de los avances en su diagnóstico y tratamiento, la tasa de mortalidad sigue siendo muy elevada, y representa la segunda causa de muerte por cáncer.
El metabolismo de la glucosa, un factor clave en los tumores intestinales
Hoy en día, es un hecho constatado por la comunidad científica que las células cancerosas metabolizan la glucosa de manera diferente a las células normales.
“En estudios anteriores nosotros ya demostramos que el metabolismo de la glucosa juega un papel clave en la iniciación de tumores intestinales en modelos murinos de cáncer colorrectal. Ahora, en este nuevo estudio hemos descubierto que en estos tumores existe una población de células que se caracterizan por tener un elevado metabolismo de la glucosa (células glucolíticas) y que se comportan como células madre, es decir, son pluripotentes y tienen la capacidad de iniciar un tumor”, explica el Dr. Carlos Sebastián, afiliado al Departamento de Biología Celular, Fisiología e Inmunología de la Facultad de Biología de la Universidad de Barcelona (UB) y al Instituto de Biomedicina de la UB (IBUB).
Estos resultados revelan que los tumores intestinales son metabólicamente heterogéneos y sugieren que existiría una jerarquía donde una pequeña población de células altamente glucolíticas serían las responsables de la iniciación y diseminación tumoral.
“Para poder analizar esta heterogeneidad, desarrollamos un novedoso sistema que, combinado con organoides intestinales (cultivos 3D que imitan la composición celular del intestino), nos ha permitido visualizar, rastrear y caracterizar células con diferentes propiedades metabólicas en el epitelio intestinal y en tumores a nivel de célula sencilla. La caracterización de las células glucolíticas nos ha llevado a descubrir que poseen actividad de célula madre intestinal y que este tipo celular también está presente en tumores intestinales”, afirma el Dr. Sebastián.
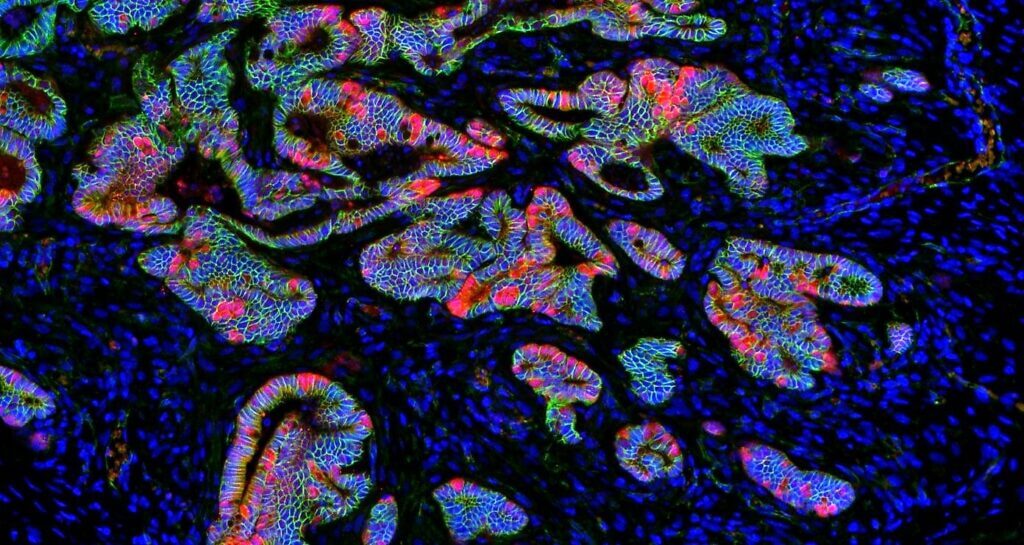
Imagen de una inmunofluorescencia donde se aprecian células con diferentes propiedades metabólicas dentro del epitelio intestinal (Autor: Carlos Sebastián).
La reprogramación metabólica en el proceso tumoral
Una de las principales características de las células tumorales es la capacidad de modificar su metabolismo (reprogramación metabólica) para crecer, sobrevivir y proliferar, lo que está íntimamente ligado a la progresión tumoral, la metástasis y la resistencia terapéutica.
Tradicionalmente, la comunidad científica ha considerado estas alteraciones metabólicas como meras adaptaciones encaminadas a proporcionar la energía y macromoléculas necesarias para la proliferación celular. “Sin embargo, nuestros estudios demuestran que esta reprogramación metabólica se produce en estadios muy tempranos del proceso tumoral y es una característica intrínseca asociada a un determinado tipo celular”, revela el científico.
Además, este equipo de investigadores ha descubierto que el bloqueo de esta reprogramación metabólica es suficiente para inhibir la capacidad de las células glucolíticas para formar tumores intestinales. “Dado que estas células iniciadoras de tumores están implicadas en la progresión tumoral, en la formación de metástasis y en la recidiva tumoral, nuestros resultados sugieren que esta vulnerabilidad metabólica podría ser empleada en el tratamiento del cáncer colorrectal”, añade.
Otra de las conclusiones importantes del trabajo es la constatación de que estas células glucolíticas son quiescentes, es decir, no proliferan, lo que apunta a que esta reprogramación metabólica no está asociada a la producción de biomasa y proliferación celular. De hecho, los investigadores han observado que estas características metabólicas son necesarias para proteger a estas células contra el estrés oxidativo y mantener su potencial de célula madre.
“Aunque estos estudios han sido realizados con modelos de cáncer de colon en ratones y, por tanto, hay que ser prudentes en trasladarlos a la enfermedad humana, los resultados podrían ser útiles en un futuro a la hora de diseñar nuevas terapias más efectivas para este tipo de cáncer. En este sentido, nuestro laboratorio sigue trabajando en esta línea con muestras derivadas de pacientes con cáncer de colon con el fin de poder aplicarles nuestros hallazgos”, destaca el investigador.
» Referencia del artículo: Sebastián C*, Ferrer C, Serra M, Choi JE, Ducano N, Mira A, Shah MS, Stopka SA, Perciaccante AJ, Isella C, Moya-Rull D, Vara-Messler M, Giordano S, Maldi E, Desay N, Capen DE, Medico E, Cetinbas M, Sadreyev RI, Brown D, Rivera MN, Sapino A, Breault DT, Agar NYR, Mostoslavsky R*. “: A non-dividing cell population with high pyruvate dehydrogenase kinase activity regulates metabolic heterogeneity and tumorigenesis in the intestine”. Nature Communications (2022). DOI: https://www.nature.com/articles/s41467-022-29085-y




