
Crean proteínas inexistentes en la naturaleza que imitan las inmunoglobulinas de los anticuerpos
Un equipo de científicos, liderados por Enrique Marcos y F. Xavier Gomis Rüth, del Instituto de Biología Molecular de Barcelona del Consejo Superior de Investigaciones Científicas (IBMB-CSIC), con sede en el Parque Científico de Barcelona, y David Baker, director del Institute for Protein Design de la Universidad de Washington, han diseñado y creado proteínas inexistentes en la naturaleza, con estructuras que imitan las inmunoglobulinas plegadas de los anticuerpos. Los resultados del trabajo, publicados en Nature Communications, pueden servir de base para el desarrollo de fármacos basados en anticuerpos monoclonales más asequibles.
La parte de los anticuerpos que se modifica es una muy concreta. “La estructura de todos los anticuerpos es muy similar, pero en sus extremos difieren en una pequeña región variable que es la que permite a cada anticuerpo reconocer de forma específica una diana”, explica Enrique Marcos. Esa región variable es un armazón estructural con inmunoglobulinas plegadas, armazón en el que se ancla una zona flexible que interactúa y reconoce directamente al patógeno.
El trabajo que se acaba de publicar describe una estrategia computacional para diseñar “pequeñas inmunoglobulinas como las de los anticuerpos con estructuras a medida, de alta estabilidad y con capacidad para anclar zonas flexibles con capacidad de unión a la diana buscada”, explican los científicos.
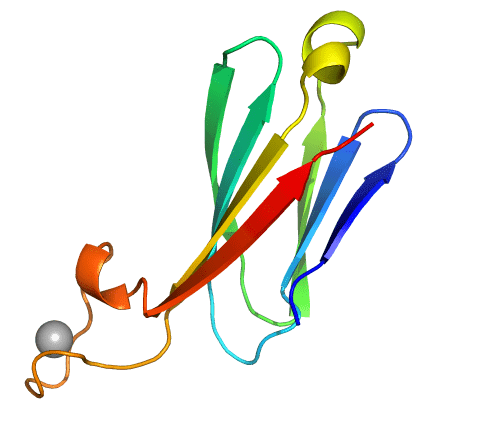
Estructura de una de las inmunoglobulinas diseñadas por los investigadores, con una zona de unión a calcio (IBMB/CSIC).
Con esta estrategia, los científicos han generado las nuevas moléculas y después han comprobado mediante cristalografía que las estructuras obtenidas eran las previstas en los modelos, lo cual significa que “las podemos diseñar con alta precisión”, añade Marcos.
El trabajo, en el que también han participado equipos de la Universidad de Toronto (Canadá), abre la puerta al diseño de proteínas similares a los anticuerpos con estructuras adaptadas a las necesidades y que presentan mejores propiedades biofísicas que los actuales, lo que representaría un gran avance para el desarrollo de fármacos más accesibles a escala global y posibilitando nuevos mecanismos de acción.
»Artículo de referencia: Tamuka M. Chidyausiku, Soraia R. Mendes, Jason C. Klima, Marta Nadal, Ulrich Eckhard, Jorge Roel-Touris, Scott Houliston, Tibisay Guevara, Hugh K. Haddox, Adam Moyer, Cheryl H. Arrowsmith, Xavier Gomis-Rüth , David Baker & Enrique Marcos. De novo design of immunoglobulin-like domains, Nature Communications volume 13, Article number: 5661 (2022) https://doi.org/10.1038/s41467-022-33004-6




