Un equip de la UB i l’IBUB revela l’extraordinària plasticitat del receptor de glucocorticoides
Un equip liderat per Eva Estébanez, investigadora de l’Institut de Biomedicina de la UB (IBUB), amb seu al Parc Científic de Barcelona, i professora de la Facultat de Biologia, revela per primer cop que el receptor de glucocorticoides (GR) és una proteïna molt plàstica i amb una estructura extraordinàriament versàtil. Aquesta descoberta contribuirà a dissenyar fàrmacs més selectius amb les formacions específiques del receptor, i també menys tòxics per evitar els greus efectes secundaris que generen els corticoesteroides clàssics en els pacients.
Els glucocorticoides, com la cortisona, són uns dels medicaments antiinflamatoris més emprats; es fan servir en el trasplantament d’òrgans i per tractar l’asma, la psoriasi i fins i tot la COVID-19. En la seva acció farmacològica és decisiva l’activitat del receptor de glucocorticoides (GR), un factor de transcripció que regula processos vitals en la fisiologia humana. Tot i això, l’estructura tridimensional detallada d’aquest receptor nuclear —una les dianes terapèutiques més importants en la indústria farmacològica— és encara una incògnita per a la comunitat científica.
Ara, un estudi publicat a la revista Nucleic Acids Research revela per primer cop que el GR és una proteïna molt plàstica i amb una estructura altament versàtil: els seus monòmers (molècules constituents) són capaços d’autoassemblar-se de maneres ben diferents per formar dímers, tetràmers i complexos amb altres proteïnes en el nucli cel·lular per controlar l’expressió de nombrosos gens.
La descoberta de la versatilitat estructural i funcional del GR i el seu procés d’autoassemblatge molecular (oligomerització) contribuirà a dissenyar fàrmacs més selectius amb les formacions específiques del receptor, i també menys tòxics per evitar els greus efectes secundaris que generen els corticoesteroides clàssics en els pacients.
Lidera l’estudi la professora Eva Estébanez, de la Facultat de Biologia i de l’IBUB, i té com a primeres coautores Alba Jiménez i Andrea Alegre (UB-IBUB). També hi participen els equips dirigits pels experts Pablo Fuentes, de l’Institut de Recerca de l’Hospital de la Santa Creu i Sant Pau; Diego Presman, de la Universitat de Buenos Aires, i Gordon Hager, dels Instituts Nacionals de Salut (NIH) dels Estats Units a Bethesda.

Lidera l’estudi la professora Eva Estébanez, de la Facultat de Biologia i de l’IBUB (Foto: UB).
Evitar els efectes secundaris dels glucocorticoides
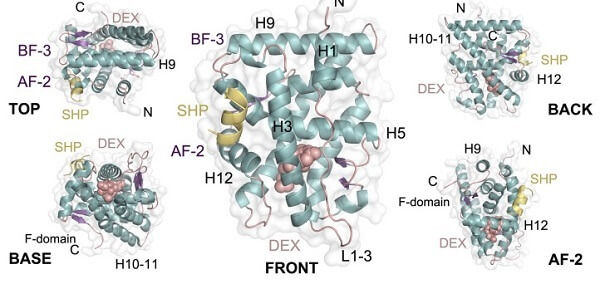
L’estructura tridimensional del GR, que és essencial per a la seva activitat fisiològica, ha estat qüestionada en la literatura científica. La primera estructura del domini d’unió als lligands del GR (GR-LBD) es va publicar el 2002 a la revista Cell. Segons aquest model, dues molècules del GR-LBD s’associaven per formar un dímer en una formació mai fins llavors descrita en receptors nuclears.
Aquesta descoberta va obrir un debat científic —que encara continua avui dia— sobre la formació del GR i el seu estat d’oligomerització a les cèl·lules. Com que les empreses farmacèutiques han tingut un gran interès per desenvolupar fàrmacs contra el GR, la major part dels estudis estructurals posteriors s’ha centrat en la interacció del GR-LBD amb els compostos terapèutics. Com a resultat, l’anàlisi de l’estat d’oligomerització del GR es va deixar de banda i es va generar una elevada quantitat de dades estructurals que van quedar-se sense analitzar en detall.
La recerca sobre l’acció dels glucocorticoides sense efectes secundaris s’ha basat exclusivament en aquest model parcial de l’estat de dimerització del GR. Tradicionalment, es considerava que el GR, un cop era activat per corticoesteroides, tenia la capacitat de dur a terme diferents funcions a la cèl·lula segons el seu estat d’oligomerització: com a monòmer reprimia gens proinflamatoris, mentre que com a dímer podia induir l’expressió de gens antiinflamatoris.
Aquest dogma va ser qüestionat quan l’equip col·laborador dels NIH a Bethesda va demostrar que el GR també podria actuar com un tetràmer (quatre molècules de GR unides, potser un dímer de dímers) i tenir activitat fisiològica, mentre que la forma monomèrica del receptor no regulava cap funció.
Tanmateix, amb la informació que es coneixia sobre l’estructura del GR no es podia explicar com formava el receptor aquests tetràmers a escala cel·lular. «El nostre treball analitza el potencial d’oligomerització del GR-LBD i constata com aquest receptor pot formar fins a 20 dímers diferents. Els resultats suggereixen que alguns d’aquests dímers es poden associar per formar tetràmers funcionals quan el receptor s’uneix a l’ADN», detalla la professora Eva Estébanez, del Departament de Bioquímica i Biomedicina Molecular de la Facultat de Biologia de la UB.
El treball també ha identificat formes hexamèriques no funcionals en mutants del GR que s’havien descrit en pacients que no responen als corticoesteroides (síndrome de Chrousos o de resistència als glucocorticoides). «Per tant, el nostre estudi associa per primer cop la formació d’oligòmers no funcionals de GR (o de qualsevol altre receptor nuclear) a una malaltia humana endocrinològica rara de resistència als glucocorticoides», indica Estébanez.
Una plasticitat estructural desconeguda en altres receptors nuclears
Per assolir els resultats, l’equip ha aplicat un ampli ventall de tècniques, des de la cristal·lografia de raigs X amb radiació de sincrotró (ALBA-CELLS), fins al mètode conegut com a number and brightness, una tècnica capdavantera de microscòpia que permet visualitzar l’estat d’oligomerització del GR en cèl·lules vives.
El treball ha permès explicar des del punt de vista estructural com es poden formar els dímers i tetràmers de GR, i com el domini d’unió al lligand és clau per a aquestes múltiples formacions. L’anàlisi de totes les dades estructurals disponibles per al GR, juntament amb les noves estructures resoltes pel grup UB-IBUB, ha permès determinar una plasticitat estructural mai vista en altres receptors nuclears.
“Aquesta versatilitat permet al GR formar dímers amb diferents formacions que es poden modular, fins a cert punt, segons el tipus de lligand que s’uneixi al receptor, i això explicaria la capacitat del GR per formar tetràmers”, indica la investigadora Alba Jiménez.
“Els nostres resultats reforcen les dades que demostren la formació de tetràmers actius quan el receptor s’uneix a l’ADN i consoliden la hipòtesi que el mecanisme d’acció del GR en la regulació de la transcripció és molt més complex i versàtil”, apunta l’experta Andrea Alegre.
Aquest abordatge multidisciplinari ha permès transferir els resultats de les observacions derivades de l’estructura de la proteïna als processos que tenen lloc a escala cel·lular, un progrés científic amb implicacions d’interès en fisiologia humana i la lluita contra algunes malalties.
» Article de referència: Jiménez-Panizo, Alba; Alegre-Martí, A. et al. “The multivalency of the glucocorticoid receptor ligand-binding domain explains its manifold physiological activities”. Nucleic Acids Research, desembre de 2022. Doi: 10.1093/nar/gkac1119
» Enllaç a la notícia: web de la UB [+]




