La evolución de la leucemia ya está escrita desde su inicio en el momento del diagnóstico
El Centro Nacional de Análisis Genómico (CNAG – CRG), con sede en el Parque Científico de Barcelona, ha participado en un estudio, coordinado por investigadores del IDIBAPS-Clínic Barcelona-UB, para identificar los mecanismos que determinan la evolución de la leucemia, las recaídas después del tratamiento y la transformación a un linfoma muy agresivo en la etapa final de algunos pacientes. El trabajo, publicado en Nature Medicine, cambia la visión de la progresión de esta enfermedad, abriendo la puerta a un diagnóstico más precoz y ofreciendo nuevas estrategias para su tratamiento.
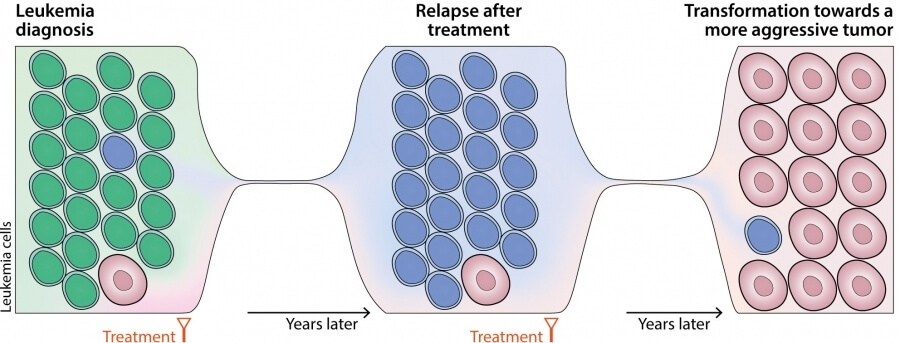
El estudio, financiado con una ayuda de la convocatoria CaixaResearch de investigación en salud de un millón de euros, demuestra que las células que provocan la recaída después del tratamiento y que darán lugar a la transformación de la leucemia en un tumor muy agresivo ya se pueden detectar en una cantidad muy pequeña al inicio de la enfermedad muchos años antes de que se manifiesten clínicamente estas complicaciones. Los resultados de este trabajo cambian la visión que se tenía de cómo progresa la leucemia.
El artículo ha sido coordinado por el Dr. Elías Campo, director del IDIBAPS y jefe del grupo de Patología molecular en neoplasias linfoides y el Dr. Ferran Nadeu, investigador pos-doctoral del IDIBAPS y del CIBERONC. Los primeros co-autores del trabajo son, además de Ferran Nadeu, Romina Royo, investigadora del Barcelona Supercomputing Center (BSC); Ramon Massoni-Badosa, investigador del Centro Nacional de Análisis Genómico (CNAG-CRG); Heribert Playa-Albinyana, investigador del IDIBAPS y del CIBERONC; y Beatriz Garcia-Torre, investigadora del IDIBAPS.
La teoría del Big Bang de la evolución del cáncer
Hasta ahora se creía que la leucemia progresaba porque sus células evolucionaban a lo largo del tiempo y se transformaban en tumores más agresivos porque adquirían alteraciones en su genoma de forma progresiva que las hacían más resistentes a los tratamientos. El nuevo trabajo demuestra que algunas de las células de la leucemia ya han adquirido estas alteraciones al inicio de la enfermedad, pero se encuentran en cantidades muy pequeñas. Durante la evolución de la enfermedad, estas células más malignas irán incrementando y de forma progresiva serán seleccionadas para dar complicaciones clínicas muchos años después de su inicio. “Es como si la célula madre de la leucemia hubiera engendrado muchísimas semillas hijas desde el inicio de la enfermedad, cada una de ellas con alteraciones diferentes que les permitirá crecer en el futuro cuando las condiciones le sean más adecuadas”, señala Elías Campo.
Estas observaciones confirman la denominada teoría del “Big Bang” de la evolución del cáncer que propone que la célula original maligna rápidamente se multiplica en un gran número de células hijas muy diversas con múltiples alteraciones que dan lugar a complicaciones futuras por un proceso de selección de las más adaptadas. “Esta nueva visión de la enfermedad abre la puerta a desarrollar pruebas diagnósticas altamente sensibles que nos permitan detectar y tratar estas semillas tan malignas muchos años antes de que puedan crecer de forma descontrolada”, explica Elías Campo.
La transformación de la leucemia linfática crónica en un tumor más agresivo
La leucemia linfática crónica (LLC) es la leucemia más frecuente en el mundo occidental, con una incidencia de unos 5 casos por cada 100.000 habitantes y año. Acostumbra a ser indolente, pero puede evolucionar hacia un linfoma de células B grandes muy agresivo que tiene una supervivencia media inferior a un año. Esta transformación tumoral se produce en aproximadamente un 5-10% de los pacientes.
Los investigadores se plantearon estudiar a fondo las alteraciones que determinan la progresión de la leucemia utilizando muestras de sangre obtenidas en diferentes momentos de la enfermedad con nuevas técnicas altamente sensibles que incluyen la secuenciación individual del genoma de miles de células tumorales en cada momento de la evolución. Se recogieron muestras de los tumores de 19 pacientes con LLC en su diagnóstico, en las recaídas después de diferentes tratamientos y hasta el momento final de la transformación a linfoma agresivo cubriendo hasta 19 años después del inicio de la enfermedad.
En el estudio, se identificaron las alteraciones genómicas que determinan la progresión y, de forma sorprendente, vieron que algunas pocas células en el momento más inicial de la enfermedad ya tenían estas alteraciones.

Ramón Massoni-Badosa, investigador del Centro Nacional de Análisis Genómico (Foto: CNAG-CRG).
«Nuestro estudio destaca que los avances tecnológicos y las posibles aplicaciones clínicas van del brazo. La genómica unicelular nos ha proporcionado un poder discriminatorio sin precedentes para detectar clones de cáncer extremadamente infrecuentes que son clave para el pronóstico y el tratamiento de la transformación de Richter», explica Ramón Massoni-Badosa, investigador del equipo de Genómica Unicelular del CNAG-CRG.
» Artículo de referencia: Nadeu, F., Royo, R., Massoni-Badosa, R. et al. Detection of early seeding of Richter transformation in chronic lymphocytic leukemia. Nat Med 28, 1662–1671 (2022). https://doi.org/10.1038/s41591-022-01927-8
» Más información: web del CNAG-CRG [+]




